发布时间:2025-10-21 09:39:58 来源: 浏览次数:180
《实用医院临床杂志》2025 年 9 月第 22 卷第 5 期
经气囊辅助小肠镜治疗小肠动静脉畸形出血疗效及安全性研究
赖文财1,2,夏至波2,冯小萌2,黄滋涵2,宁守斌2,李白容2
1 河北北方学院研究生院,河北 张家口 075000;
2 中国人民解放军空军军医大学特色医学中心消化内科,北京 100142
摘要:目的:总结经气囊辅助小肠镜( balloon-assissted enteroscopy,BAE) 对空肠和回肠动静脉畸形( arteriovenous mal formation,AVM) 所致小肠出血患者的治疗有效性和安全性。
方法:2016 年 4 月至 2024 年 12 月确诊孤立性空回肠 AVM 所致小肠出血并接受内镜治疗的 20 例患者。根据内镜干预方式不同,将患者分为内镜下硬化剂治疗联合止血夹组( 硬化剂组) 和氩等离子体凝固术( APC) 联合止血夹组( APC 组) ; 所有患者在治疗后均接受长期随访,评估其止血效果及再出血情况。
结果:20 例小肠出血患者经 BAE 诊断为 AVM,其中 16 例同意接受内镜治疗,2 例选择手术治疗,2 例拒绝干预。在内镜治疗中 3、6、12 个月再出血率分别为 18.75%( 3 /16) 、25%( 4 /16) 、43.75%( 7 /16) 。对硬化剂组和 APC 组进行比较,3、6、12 个月再出血率分别为 27.27%vs 0%、36.36%vs 20%、36.36%vs 60%,差异无统计学意义( P>0.05) 。
结论:BAE 下实施内镜治疗在空肠和回肠 AVM 所致小肠出血患者中具有良好的止血效果及较低的再出血风险; 硬化剂联合止血夹与 APC 联合止血夹均为安全、可行的内镜治疗手段,两者短期疗效相近,但内镜下硬化剂治疗在远期疗效方面可能具有一定优势。
关键词:小肠出血; 动静脉畸形; 气囊辅助小肠镜; 内镜治疗
小肠出血占胃肠道出血的 5% ~ 10%,其病因复杂且出血位置常隐匿,血管性疾病是其中最常见的出血原因之一,占比可达 20% ~ 30% [1~ 6]。在血管性疾病中,血管扩张症( AE) 较为常见且被广泛认识,而动静脉畸形( arteriovenous malformation,AVM)作为另一类重要血管性病变,相关的报道相对较少,临床认知有限; 但由 AVM 引起的小肠出血往往量大、难以控制,甚至危及生命。小肠 AVM 通常难以诊断,确定最佳治疗方案也颇具挑战。从组织病理学来看,AVM 表现为动静脉之间直接相连,缺乏正常毛细血管床,血管壁增厚不均[7,8]。根据矢野山本等对小肠血管病变的内镜分型,肠道 AVM 可归类为Ⅲ型( 搏动性红色突起伴周围静脉扩张) ; 部分先天性 AVM 则表现为息肉样病变,归为 IV 型( 未明确的血管病变) [5,7,9]。文献报道成人 AVM 多为孤立性病灶,主要分布于小肠 ( 约 37%) 、胃( 12%) 及右半结肠( 43%) [10,11]。在内镜检查中,AVM 通常表现为扁平或隆起的鲜红色病变; 由于多数小肠 AVM 体积较小、位于黏膜下,仅表现为黏膜点状糜烂,即使引起大量出血,也常难以在内镜下发现; 部分病例甚至需在剖腹探查时,通过视诊或触诊仍难以明确病灶位置[12]。目前,由于缺乏大规模临床试验,治疗肠道 AVM 病变的最佳方法尚未明确[7],现行治疗方式主要包括栓塞术和节段性肠切除术,虽然对供血动脉的结扎或栓塞可暂时止血,但复发率较高,栓塞更多被建议作为术前辅助措施[13]; 而对于术中发现的病灶,节段性切除术仍为传统标准治疗方式[14,15]。随着气囊辅助小肠镜( balloon-assissted enteroscopy,BAE) 的应用愈发广泛且技术逐步成熟,一些 AVM 病例在有消化道出血静息期通过 BAE 可诊断[16,17]。有文献报道称,氩离子凝固术( argon plasma coagulation,APC) 和金属夹可有效且安全地用于治疗肠道血管畸形[17]。部分孤立性息肉样 AVM 甚至可在上消化道或结直肠行内镜下黏膜切除术( EMR/ESD) ; 此外,直接穿刺硬化治疗被推荐作为皮肤和肛管 AVM 的可选治疗方法之一,但其在小肠 AVM中的应用鲜有报道[13,18]。孤立性小肠 AVM 的治疗方案需根据病变的大小、部位和状态( 活动性出血、有血凝块覆盖或静止状态) 进行综合评估[19,20]。我中心将 BAE 硬化治疗用作孤立性肠道 AVM 的首选微创治疗方法,检索文献尚无报道。本文总结了 20 例空肠或回肠的孤立性 AVM 经 BAE 内镜治疗的经验及长期随访结局,现报道如下。
一、 资料与方法
1.1 一般资料
回顾性收集了 2016 年 4 月至 2024年 12 月我中心经 BAE 诊断为空肠和回肠 AVM 的20 例患者的临床资料。纳入标准: ①经 BAE 检查,确诊为位于空肠或回肠 AVM; ②临床表现为疑似小肠出血( 包括黑便、血便、顽固性缺铁性贫血等) ,排除上消化道及结肠出血后确定为小肠出血; ③具备完整的随访资料且随访时间不少于 6 个月。排除标准: ①AVM 病灶位于空肠或回肠以外部位( 如胃、十二指肠或结肠) ; ②合并其他明确可解释出血的病因( 如肿瘤、克罗恩病、NSAIDs 相关溃疡等) ; ③因严重基础疾病( 如重度心力衰竭、肝硬化、凝血功能障碍) 无法耐受内镜治疗。其中 16 例患者同意接受内镜治疗,2 例选择手术治疗,2 例未进行干预。
1.2 方法
1.2.1 收集临床资料 包括人口统计学特征、病史、合并疾病、内镜特征、治疗方法以及确诊后的结局; 治疗后,对患者进行了至少 6 个月的随访。
1.2.2 BAE操作 BAE的操作时机与路径根据患者的临床表现、影像学及胶囊内镜检查结果、一般状况及合并基础疾病综合评估决定。对于出现急性大量出血( 定义为血流动力学不稳定且需要输血) 的患者,进行急诊小肠镜( 活动性出血 24 h 内)检查。
BAE 的进镜方式根据可疑病变的估计位置而定: 对于位于空肠和回肠近端的病变,优先选择经口途径; 对于位于回肠近端以远的病变,优先选择经肛途径; 若无法估计病变位置,发现黑便则优先进行经口内镜检查,发现血便则优先进行经肛内镜检查。当一侧内镜检查未能发现出血病变时,则进行另一侧内镜检查。经口途径进行 BAE 前,患者需禁食 12 小时; 经肛门途径进行 BAE 时,使用聚乙二醇电解质散进行肠道准备。考虑到肠道准备可能诱发或加重出血,应在具备处理严重胃肠道出血条件的环境下进行,包括持续监测生命体征、备血、并准备急诊小肠镜检查、数字减影血管造影( digitalsubtraction angiography,DSA) 或外科手术干预; 如出现出血,酌情及时中止肠道准备。
四名经验丰富的内镜医师使用气囊辅助小肠镜( SIF TYPE Q260,日本奥林巴斯公司) 进行小肠镜检查; 在操作过程中,采用氟比洛芬联合瑞芬太尼静脉镇痛镇静; 如遇肠道蠕动干扰镜身推进或观察,可静脉注射 5~20 mg 盐酸消旋山莨菪碱抑制蠕动。当镜下发现病灶、完成全小肠对接检查或无法继续进镜时开始退镜。若发现明确出血病灶,即行内镜下止血,一般不强行深插镜身以降低风险。如首次检查未发现病灶,可于最远插入处使用止血夹进行标记,继而从对侧再次检查。内镜止血方法的选择取决于内镜医生的偏好和内镜设备,包括聚桂醇( 1. 0%) 注射治疗或氩等离子体凝固术 ( argon?plasma coagulation,APC) ,两者均可与止血夹联合使用。硬化剂联合止血夹法: 如活动性出血影响视野,先行止血夹夹闭病灶出血点; 随后根据病灶大小,于黏膜下注射 0.5 ~ 2.0 ml 聚桂醇溶液; 根据注射后是否持续渗血决定是否再次放置额外止血夹( 图 1) 。APC 方式: 先对出血病灶及周围组织进行非接触式、均匀的浅表凝固处理,毁损病变可见血管成分,随后根据创面情况予以单个或多个止血夹缝合创面、避免局部迟发穿孔(图2) 。
1.3 相关定义
①疑似小肠出血( suspected small?bowel bleeding,SSBB) 指在接受标准的上消化道内镜和结肠镜检查后仍未明确出血原因的胃肠道出血。不明原因消化道出血 ( obscure gastrointestinalbleeding,OGIB) 是指在完成标准内镜检查( 包括上消化道内镜和结肠镜) 、小肠胶囊内镜、小肠镜及相关影像学检查后,仍无法明确出血原因的持续性或复发性胃肠道出血[5,7]。②AE 是指内镜下可见的、位于黏膜或黏膜下直径 2 ~ 10 mm 的红色扁平蛛网状、树枝状或斑片状病变[7,12]。③孤立性 AVM 是指在小肠镜下可见的局部有规律性搏动的病变、呈轻度隆起的肿瘤样、表面有红色斑[1,7,9]。
1.4 治疗有效性指标
①消化道出血症状缓解: 治疗有效的近期表现定义为: 患者在接受内镜治疗后的住院期间,未再出现以下出血相关症状或体征:黑便或血便等肉眼可见的消化道出血表现; 心率增快、血压下降等血流动力学异常; 血红蛋白持续下降或有新增输血需求; 出现上述任一情形者,判定为“症状未完全缓解”[7,10~ 13]。②疗效: 以治疗后 3、6 及 12 个月内是否发生再出血作为主要指标。无再出血是指患者在上述随访时间节点内,无再次出现黑便、血便等出血表现,且无血红蛋白显著下降( ≥20 g /L) 或需新增输血,无影像/内镜证实再出血者[5,9,12]; 患者的累积无再出血生存率分别在内镜治疗后第 3、6、12 和 18 个月进行评估,用于判定远期疗效。
1.5 随访
随访内容包括是否再次出血、再次出血的原因以及随访期间的处理措施。通过门诊及电话随访,询问患者治疗后 3、6、12 个月至末次随访时的情况,末次随访时间为 2025 年 5 月 27 日。如患者出现消化道出血则及时复诊,其中有效观察指标为随访患者消化道是否再出血情况。
1.6 统计学方法
应用 SPSS 27.0 统计学软件分析数据。呈正态分布的计量资料以均数 ±标准差表示,组间比较采用 t 检验,呈偏态分布的计量资料以M( Q1,Q3 ) 表示,组间比较采用秩和检验; 计数资料以例数( %) 表示,组间比较采用卡方检验或确切概率法; 采用 Kaplan-Meier 法计算随访期内累积无再出血生存率。P<0.05 为差异有统计学意义。
二、 结果
2.1 AVM 患者基本临床特征
从 2016 年 4 月至2024 年 12 月,共有 20 例小肠大量出血患者通过BAE 确诊为空回肠 AVM。患者首发年龄为( 61.55± 14.01) 岁,体质指数( BMI) 为( 23.45 ± 4.03) kg /m2; 病程为 36.00( 13. 50,63. 00) 个月; 男 7 例( 35.00%) ,女 13 例( 65.00%) ; 入院时有血流动力学不稳定者 3 例( 15.00%) ; 合并疾病方面,高血压最常见( 7 例,35.00%) ,其次为糖尿病( 4 例,20.00%) 及冠心病( 3 例,15.00%) ; 多数患者存在中重度贫血表现( 17 例,85. 00%) ; 既往有输血史者 16 例( 80.00%) ,既往腹部手术史 9 例( 45. 00%) ,3 例( 15.00%) 长期使用非甾体抗炎药或抗栓药物; 生活方式方面,有吸烟史7 例( 35. 00%) ,饮酒史6 例( 30.00%) 。
2.2 治疗情况及转归
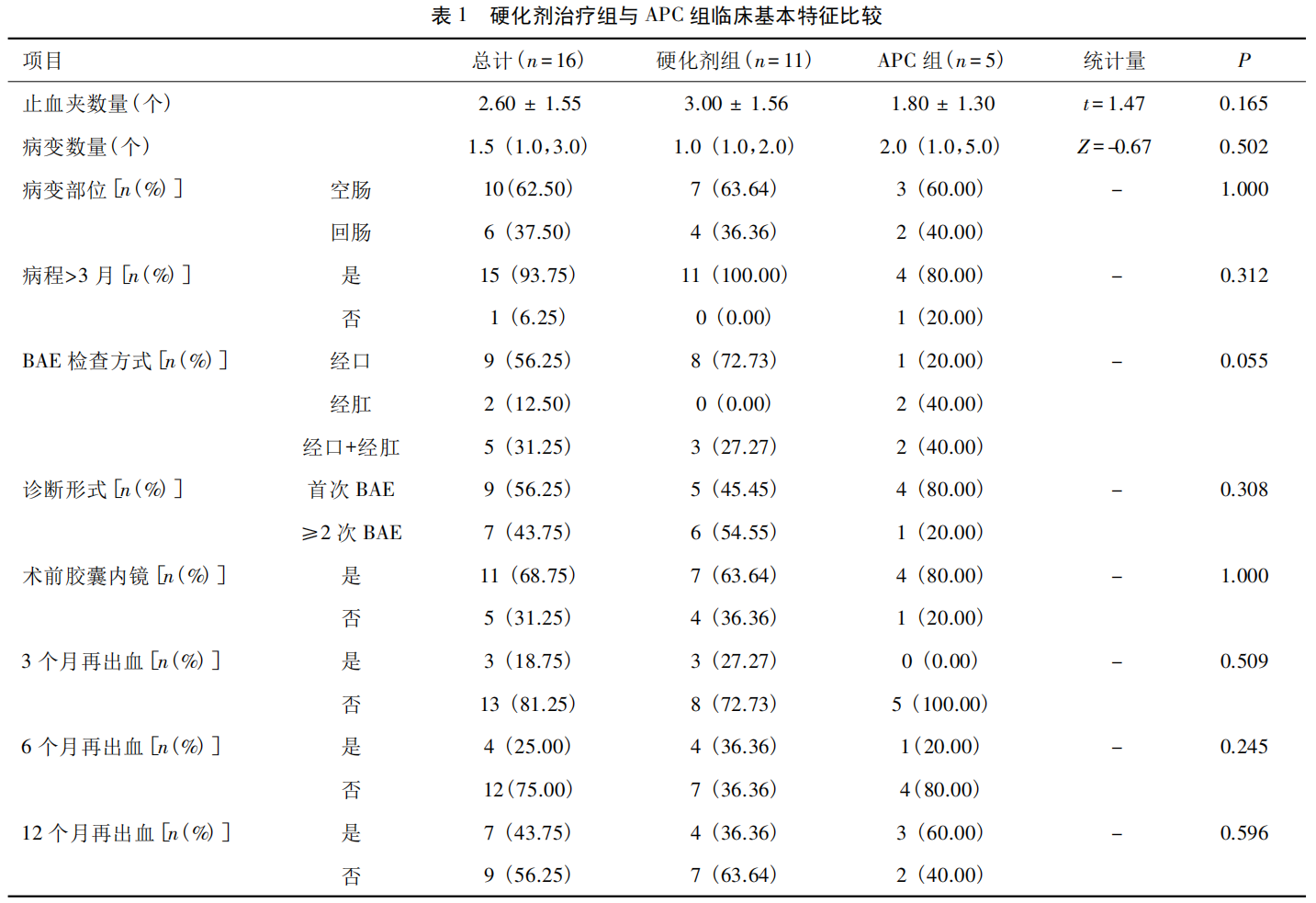
20 例患者中 11 例接受内镜下硬化剂联合止血夹治疗,使畸形血管硬化纤维化后消失; 5 例接受 APC 联合止血夹治疗。在随访期间有 7 例患者再次出血,再出血原因分别为既往治疗部位病变、结肠 AE 和原因不明。内镜下治疗未发生包括大量出血、穿孔和感染在内的严重并发症。表 1 对接受内镜治疗的 16 例患者中硬化剂治疗组( n = 11) 与 APC 组( n = 5) 患者的临床特征、治疗方式及预后进行比较。硬化剂组中 8 例为单发病变( 72.73%) ,3 例为多发病变( 27.27%,最多 2 处) ;APC 组中 3 例为单发病变( 60.00%) ,2 例为多发病变( 40.00%,2 处为 AVM,3 处为 AE) ; 两组病程、病变部位、BAE 诊断方式、诊断形式及术前胶囊内镜检查等比较,差异无统计学意义( P>0.05) 。随访期间,两组患者在内镜治疗后不同时间点的再出血率分别为硬化剂组 27.27%( 3 /11) 、36.36%( 4 /11) 和36.36%( 4 /11) ,APC 组 0.00%( 0 /5) 、20.00%( 1 /5)和 60.00%( 3 /5) ,差异无统计学意义( P>0.05) 。
2.3 BAE中病灶表现
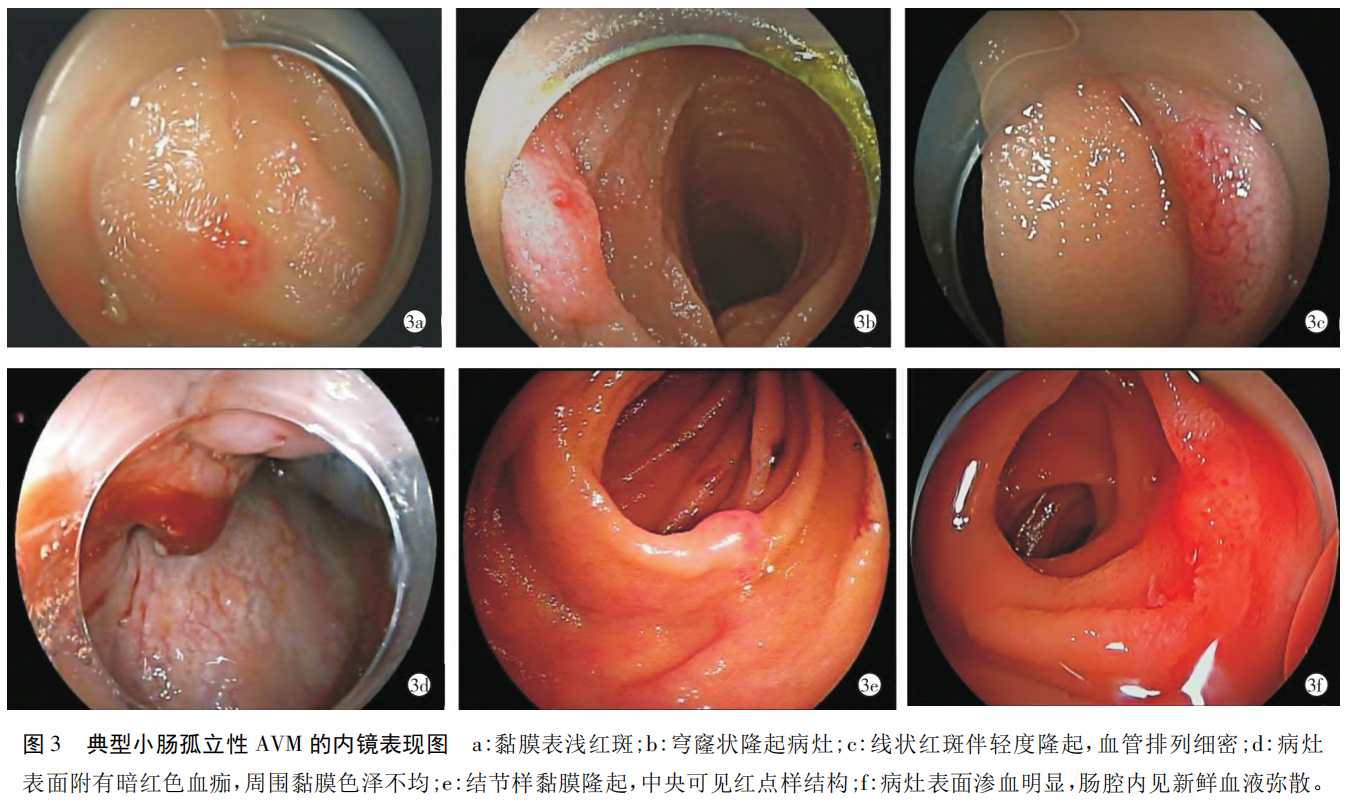
在 BAE 中病灶形态多样,但具有一定的共同特征。部分病灶表现为黏膜表浅红斑,表面可见细小渗血点并伴有局限性规律性搏动( 图 3a) ,提示黏膜下血管异常; 部分病灶呈穹窿状隆起,边界清晰,黏膜表面色泽鲜红( 图 3b) ,常见于典型黏膜下 AVM; 另有病灶呈线状红斑或黏膜轻度隆起( 图 3c) ,血管排列细密,无明显出血,考虑为低流速或静止期病变。部分病灶表面覆暗红色血痂,周围黏膜色泽改变( 图 3d) ,提示为近期出血后病灶; 图 3e 显示一结节样隆起,中央可见红点样结构,表面光滑,考虑为黏膜下血管异常的外在表现; 图 3f 中病灶表面见新鲜血液渗出,肠腔内可见血液弥散,为典型活动性出血表现,需立即干预。上述内镜下表现反映了小肠 AVM 在临床中的多样性,其形态特征可能与病变层次、血流状态及出血时间密切相关。

2.4 患者生存分析
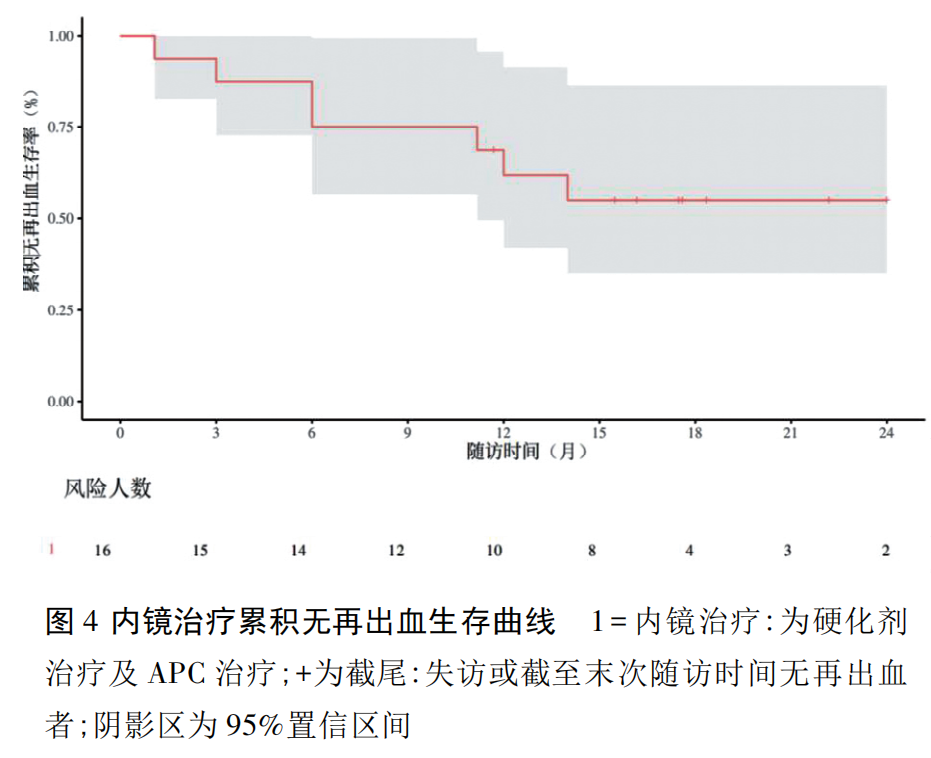
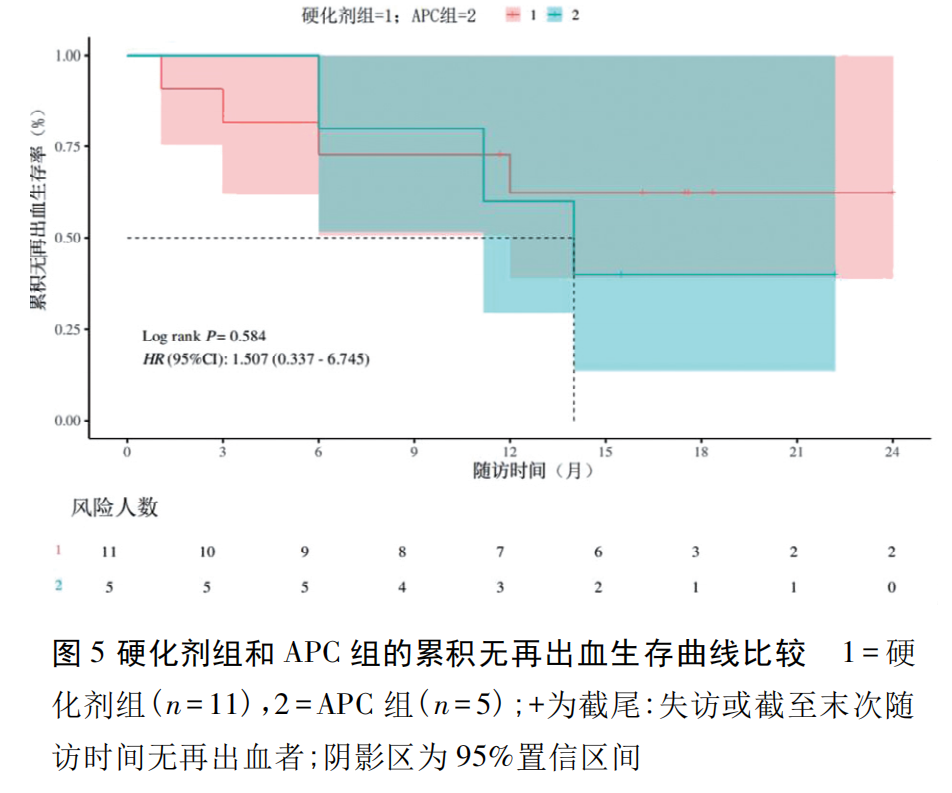
本研究使用 Kaplan-Meier 法对 16 例患者进行生存分析,终点事件定义为再出血,其中 3、6、12、18 个月累积无再出血生存率分别为 87.5%、75.0%、61.9%、55.0%,且 14 个月后无新增终点事件( 图 4) 。同时对硬化剂组与 APC 组进行生存分析分组比较,3、6、12、18 个月累积无再出血生存率分别为 81.8%vs 100%、72.7%vs 80%、62.3%vs 60%、62.3%vs 40%,尽管受限于样本量小,差异无统计学意义( P>0.05) ,但硬化剂组 12 个月后未发生终点事件,而 APC 组仍有再出血事件发生,显示出硬化剂治疗或可改善长期止血稳定性( 图5) 。
三、 讨论
消化道 AVM 是引起消化道出血的重要病因之一,在 OGIB 病例中尤为值得关注[1,9],在反复出血、依赖输血的患者中应高度警惕它的存在。AVM 的临床表现多为间歇性黑便或慢性失血性贫血,部分病灶因分布于小肠或黏膜下而易被常规检查遗漏,增加了诊断难度与延误治疗的风险[5~8]。据血管造影特征、病变部位、患者年龄及家族史,消化道 AVM可分为三型: 1 型为获得性病变,通常位于右半结肠,病灶较小、孤立,常见于 55 岁以上患者; 2 型为先天性病变,好发于小肠,病灶较大,常见于年轻患者; 3 型具有家族遗传性,典型代表为遗传性出血性毛细血管扩张症( hereditary hemorrhagic telangiectasia,HHT) 。本研究纳入患者均为 1 型和 2 型 AVM[12,16]。目前,AVM 的病因和病理机制尚未完全明确,尚难准确评估其在小肠出血病因中所占的比例。
本研究患者以中老年人为主,多表现为黑便、贫血,部分病灶即便通过 CT 血管成像( CTA) 也未能检出; 但由于大多数小肠 AVM 为先天性病变,对于年轻患者也需格外谨慎,目前,BAE 在 AVM 的诊断中价值逐步显现,已被推荐用于相关检查[21~ 23]。因为 CT 小肠造影在检出率方面表现较好,也被推荐作为小肠 AVM 的有效影像学检测手段[24]。此外,考虑到可能存在多发病灶,有必要进行动态增强 CT 检查,有报道称,5% ~ 37%接受 AVM 切除术的患者会再次出血,其中一个原因是切除不完全[1,25,26]。当出现大量消化道出血或病变位于小肠的情况下,选择性血管造影或放射性核素红细胞标记扫描( 闪烁扫描法) 可检测到这些病变[12],但目前尚没有一种诊断方法的灵敏度能达到 100%;不过,在手术切除的情况下,病理检查仍然是确诊的金标准[21,27~ 29]。
可靠的 BAE 检查对于及时发现孤立性小肠AVM 至关重要,在小肠血管性病变中,AE 和 AVM虽在内镜下均可表现为红色病灶,但二者在病理特征及临床表现上存在明显差异[1,7,15]。AE 属于静脉性病变,内镜下常见为点状或斑片状红斑,病灶表浅,可为多发,搏动性不明显。相比之下,AVM 为动静脉直接交通形成的异常血管团,病理上呈管壁肥厚、缺乏毛细血管床的特点,内镜下通常表现为孤立的、隆起性鲜红斑块或黏膜下肿物样病灶,常伴有搏动,出血倾向更强,临床上多呈急性或活动性出血; 目前研究普遍认为,AVM 在小肠中多呈孤立性病变,尤以 Moore 分型中的 2 型( 先天性) AVM为典型,常见于青壮年人群[23~ 25]。多发性 AVM 相对罕见,若在单一患者中发现多个搏动性病灶,应高度警惕潜在的系统性血管异常,如 HHT。在本研究中,虽仅 3 例患者在 CTA 检查中明确提示小肠动静脉血管畸形,但 CTA 在术前仍具有重要价值,尤其在出血活动期,有助于发现潜在的显性病灶及指导内镜检查路径,因此建议在进行 BAE 检查前常规行 CTA 评估。同时,在插入及拔出肠镜过程中应仔细观察,避免遗漏微小的肿瘤样病变或黏膜下隆起。部分病变处可见规律性搏动,活动性病变多表现为正在出血,而静止性病变则通常为轻度隆起,表面可见斑片状红斑。准确诊断是治疗的前提,手术或内镜治疗多数可获得良好预后。据报道,约25%具有反复出血病史,且经上下消化道影像及内镜、小肠检查均未发现病因的患者,最终可在选择性动脉造影中检出 AVM [12] 。
传统上,鉴于小肠 AVM 再出血风险高,手术切除被视为主要治疗方式。然而,术中精确定位病变仍面临挑战,即使术前已行血管造影或肠壁透照法辅助定位[30]。研究显示,内镜标记( 如染色剂注射、止血夹放置) 及术中吲哚菁绿荧光显像可提升病变检出率[7,9,30~ 32]。肠系膜血管造影联合超选择性微线圈栓塞术虽能实现即时止血( 成功率约 96%) 并为手术定位提供参考,但近端供血动脉结扎或栓塞后早期再出血率仍高达 20%[33]。该技术相关严重并发症( 包括动脉夹层及肠壁缺血性坏死) 发生率可达 17%,极大限制了其临床应用[33]。因此,目前主张将栓塞术作为过渡性治疗手段,而非最终方案,建议在栓塞后 72 小时内限期行手术切除[13]。
由于缺乏大型临床试验,治疗肠道 AVM 病变的最佳方法仍不明确[7]。APC 已广泛用于治疗胃肠道出血和血管畸形,也可用于治疗与 HHT 相关的AVM[34]。与 Dieulafoy 病变类似,在内镜下表现为平坦或轻度隆起出血点的小 AVM,在 BAE 操作期间可使用内镜夹进行机械止血治疗[7]。在我中心,内镜硬化剂联合止血夹治疗是首选治疗方法。一方面,AVM 可能起源于黏膜下层或固有肌层,使用APC 治疗可能导致 AVM 成分残留或肠穿孔。硬化剂治疗可能会使动脉直接通向静脉的通道闭塞,并使其逐渐消失。本研究中比较了内镜下硬化剂联合止血夹与 APC 联合止血夹治疗小肠 AVM 的疗效; 结果显示,两组在内镜治疗后不同时间点的再出血率存在差异; 硬化剂组 12 个月再出血率为 36.36%,低于 APC 组的 60.00%,提示内镜下硬化剂治疗在远期疗效方面可能更具优势。它的理论基础在于注射硬化剂后可封闭黏膜下的异常血管通道,尤其适用于 AVM 起源于黏膜下或固有肌层的情况。相比之下,APC 可能存在病变残留风险。本研究部分再出血病例亦考虑与硬化不充分或病变残余有关,经再次治疗后随访期间未见复发。本研究共有 7 例患者在随访期间未再次发生消化道出血; 1例因右半结肠存在多发血管扩张,术后出现活动性出血而复发; 另有 3 例可能因初次硬化治疗不充分于术后数月再次出血,经补充硬化剂治疗后未见复发,进一步支持了它在深层病灶控制和疗效稳定性方面的潜在优势。
综上所述,BAE 是诊断和处理小肠孤立性 AVM的有效手段。内镜下硬化剂联合止血夹与 APC 联合止血夹均为安全、可行的治疗方式,短期疗效相近。对于病灶较深或出血频繁的患者,硬化剂可能提供更好的远期止血效果,值得进一步验证。本研究亦存在一定局限性: 首先,样本量较小,尤其是APC 组例数有限; 其次,本研究为单中心回顾性分析,可能存在选择偏倚,限制了结论的普遍性; 而且部分患者随访时间尚不足以评估远期疗效。因此,仍需大样本、长期随访的前瞻性研究,以全面评估各内镜治疗方式的疗效差异与安全性。




